溶質質量分數計算方式
溶質質量分數操作步驟
關于溶液稀釋或增濃的計算:
①關于溶液稀釋的計算
因為溶液稀釋前后,溶質的質量不變,所以若設濃溶液質量為A g,溶質的質量分數為a%,加水稀釋成溶質的質量分數為b%的稀溶液B g,則A g×a%=B g×b%(其中B=Am水)
②關于溶液增濃(無溶質析出)的計算
溶液增濃通常有幾種情況:
a、向原溶液中添加溶質:
因為溶液增加溶質前后,溶劑的質量不變。增加溶質后,溶液中溶質的質量=原溶液中溶質的質量 增加的溶質的質量,而溶液的質量=原溶液的質量 增加的溶質的質量。所以,若設原溶液質量為A g,溶質的質量分數為a%,加溶質B g后變成溶質的質量分數為b%的溶液,則A g×a% B g=(A g B g)×b%。
b、將原溶液蒸發去部分溶劑
因為溶液蒸發溶劑前后,溶質的質量不變。所以,若設原溶液質量為A g,溶質的質量分數為a%,蒸發B g水后變成溶質的質量分數為b%的溶液,則:A g×a%=(A g-B g)×b%。
c、與濃溶液混合
因為混合后的溶液的總質量等于兩混合組分溶液的質量之和,混合后的溶液中溶質質量等于兩混合組分的溶質質量之和。所以,設原溶液質量為 A g,溶質的質量分數為a%,濃溶液質量為B g,溶質的質量分數為b%,兩溶液混合后得到溶質的質量分數為c%的溶液,則:A g×a% B g× b%=(A g B g)×c%。
6、關于溶質質量分數運用于化學方程式的計算:
解這類問題時要注意:
①化學方程式下相對應的物質質量不能直接寫溶液質量,而要寫參加化學反應的溶質實際質量。
②若已知溶液的體積或求溶液的體積,要用m=ρV這個公式進行換算。
③單位要統一。
7、關于溶液中溶質的質量分數計算的具體情況
①若溶質全部溶于水,且不與水發生化學反應,直接利用上述計算公式進行計算。
②若溶質雖不與水反應,但沒有全部溶解,則溶質質量只計算溶解部分,未溶解部分不能參與計算。
③若溶質溶于水時與水發生了化學反應,則溶液中的溶質就為反應后的生成物了。
④若溶質為結晶水合物,溶于水后,其溶質的質量就不包括結晶水的質量。因為結晶水合物溶于水時,結晶水就轉化為溶液中的溶劑了。 ⑤關于酸、堿、鹽溶液間發生1~2個化學反應,求反應后所得溶液——溶質質量分數問題的計算。首先要明確生成的溶液中溶質是什么,其次再通過化學反應計算溶質質量是多少,(往往溶質質量由幾個部分組成)最后分析各量間關系求出溶液總質量,再運用公式計算出反應后溶液中溶質的質量分數。
⑥給定溶液中某種元素的質量分數或溶液中某種離子與水分子的個數比等形式,計算溶質的質量分數。如某NaCl溶液中,Na ︰H2O(數目)=1︰100,計算NaCl的質量分數。
溶質質量分數方法探討
對于反應后所得溶液的質量有兩種求法:a、溶液組成法
溶液質量=溶質質量 溶劑質量,其中溶質一定是溶解的,溶劑水根據不同的題目通常有兩種情況:①原溶液中的水,②化學反應新生成的水。
b、質量守恒法
溶液質量=m(反應)-m↓-m↑,此法較為簡單,其m(反應)代表反應物(或溶液)質量總和,m↓表示不溶固體及生成沉淀的質量,m↑表示生成氣體的質量。
溶質質量分數公式
溶解度的計算公式
飽和溶液的質量分數(C)=S/(100 S)*100%
S=M質/M劑*100 g
8.溶解度曲線
溶質質量分數意義
曲線上每一點表示該物質在某溫度下的溶解度
曲線上方的點表示溶質和溶液共存的飽和溶液
曲線下方的點是不飽和溶液
整條曲線表示在不同溫度下的溶解度變化情況
兩條曲線交點表示該溫度下兩種物質的溶解度相等
溶質質量分數應用
給出不同物質溶解度曲線,比較同溫下溶解度大小
根據溶解度受溫度影響程度,確定物質分離、提純的方法。如受溫度影響較大,則用降溫結晶,如受溫度影響較小,則用蒸發結晶2100433B
溶質質量分數造價信息
應該注意:
①溶質的質量分數只表示溶質質量與溶液質量之比,并不代表具體的溶液質量和溶質質量。
②溶質的質量分數一般用百分數(百分比)表示。
③溶質的質量分數計算式中溶質質量與溶液質量的單位必須統一。
④計算式中溶質質量是指被溶解的那部分溶質的質量,沒有被溶解的那部分溶質質量不能計算在內(未溶解部分溶質質量不歸結于溶液內)。
2、飽和溶液、不飽和溶液與溶質的質量分數的關系
溶質的質量分數和飽和不飽和無直接關系
但在飽和溶液中,溶質的質量分數=溶解度/(溶解度 100 g)
①濃溶液中溶質的質量分數大,但不一定是飽和溶液,稀溶液中溶質的質量分數小,但不一定是不飽和溶液。
3、溶質的質量分數與溶解度的區別與聯系
溶解度是用來表示一定溫度下,某物質在某100克溶劑中溶解該物質質量大小,常用單位為質量單位。
溶質的質量分數與溫度有關,需交代清楚溫度大小。
4、反應后溶液的質量=反應前各組份之和-m氣體-m沉淀
溶質質量分數計算方式常見問題
溶質質量分數計算方式文獻

 靜壓箱制作計算方式
靜壓箱制作計算方式
格式:pdf
大小:26KB
頁數: 2頁
評分: 4.4
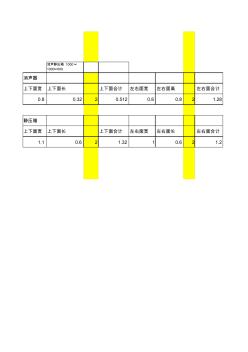
消聲靜壓箱 1000× 1000×600 消聲器 上下面寬 上下面長 上下面合計 左右面寬 左右面高 左右面合計 0.8 0.32 2 0.512 0.8 0.8 2 1.28 靜壓箱 上下面寬 上下面長 上下面合計 左右面寬 左右面長 左右面合計 1.1 0.6 2 1.32 1 0.6 2 1.2 前后面長 前后面高 前后面合計 合計面積 單價(主材價) 合計 0.32 0.8 2 0.512 2.304 190 437.76 前后面長 前后面寬 前后面合計 合計面積 單價 合計 1.1 1 2 2.2 4.72 250 1180

 鋼筋籠計算方式
鋼筋籠計算方式
格式:pdf
大小:26KB
頁數: 2頁
評分: 4.3
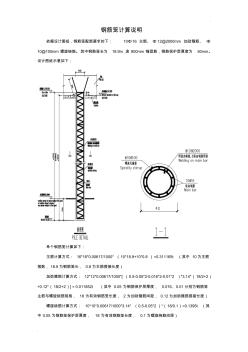
. . 鋼筋籠計算說明 依據設計圖紙,鋼筋籠配筋要求如下: 10Φ16 主筋、 Φ 12@2000mm 加勁箍筋、 Φ 10@100mm 螺旋繞筋。其中鋼筋籠長為 18.9m,含 800mm 錨固筋,鋼筋保護層厚度為 50mm。 設計圖紙示意如下: 單個鋼筋籠計算如下: 主筋計算方式: 16*16*0.00617/1000* (10*18.9+10*0.8 )=0.311165t (其中 10為主筋 根數, 18.9為鋼筋籠長, 0.8為主筋搭接長度) 加勁箍筋計算方式: 12*12*0.00617/1000*[ (0.5-0.05*2-0.016*2-0.01*2 )*3.14*(18/2+2) +0.12*( 18/2+2)] = 0.011852t (其中 0.05 為鋼筋保護層厚度, 0.016、0.01分別為鋼筋籠 主筋與螺旋繞筋規格, 18 為有效鋼筋籠長度, 2 為加勁箍
質量分數公式是計算質量分數的公式,質量分數是指某物質中某種成分的質量與該樣品中總物質質量之比的百分數,如在溶液中溶質質量與溶液質量之比的溶質質量分數、在混合物中某種成分的質量分數、在化學式中某種元素的質量分數等。
注意:
1、溶質的質量分數只表示溶質質量與溶液質量之比,并不代表具體的溶質質量和溶液質量。
2、溶質的質量分數一般用百分數表示。
3、溶質的質量分數計算式中溶質質量與溶液質量的單位必須統一。
4、計算式中溶質質量是指被溶解的那部分溶質的質量,沒有被溶解的那部分溶質質量不能計算在內。
1、關于溶液稀釋的計算
因為溶液稀釋前后,溶質的質量不變,所以若設濃溶液質量為A g,溶質的質量分數為a%,加水稀釋成溶質的質量分數為b%的稀溶液Bg,則A g×a% = B g×b%(其中B = Am水)
2、關于溶液增濃(無溶質析出)的計算
溶液增濃方法
a、向原溶液中添加溶質
因為溶液增加溶質前后,溶劑的質量不變。增加溶質后,溶液中溶質的質量=原溶液中溶質的質量 增加的溶質的質量,而溶液的質量=原溶液的質量 增加的溶質的質量。所以,若設原溶液質量為A g,溶質的質量分數為a%,加溶質B g后變成溶質的質量分數為b%的溶液,則 A g×a % B g=(A g B g)×b%。
b、將原溶液蒸發去部分溶劑
因為溶液蒸發溶劑前后,溶質的質量不變。所以,若設原溶液質量為A g,溶質的質量分數為a%,蒸發B g水后變成溶質的質量分數為b%的溶液,則A g×a%=(A g - B g)×b%。
c、與濃溶液混合
因為混合后的溶液的總質量等于兩混合組分溶液的質量之和,混合后的溶液中溶質質量等于兩混合組分的溶質質量之和。所以,設原溶液質量為A g,溶質的質量分數為a%,濃溶液質量為B g,溶質的質量分數為b%,兩溶液混合后得到溶質的質量分數為c%的溶液,則A g×a% B g× b%=(A g B g)×c%。2100433B
本微課主要講解了用固體和水配制溶液、用濃溶液和水配制稀溶液的具體方法和操作步驟。同時,利用模擬實驗室的軟件再現整個實驗流程,將理論與實踐有機的結合在一起。
- 相關百科
- 相關知識
- 相關專欄
- 滁州國振建設工程有限公司
- 滁州天禾建筑工程有限公司
- 滁州富達機械電子有限公司
- 滁州市中冶華天水務有限公司
- 滁州市華云防雷工程有限責任公司
- 滁州市同舟工程咨詢有限公司
- 滁州市城投工程咨詢管理有限公司
- 滁州市大茆皮革機械有限公司
- 滁州市正啟建筑安裝工程有限公司
- 滁州市瑞業電力設備安裝有限公司
- 滁州市經緯模具制造有限公司
- 滁州市蘇滁現代產業園建設發展有限公司
- 滁州市金潤科技有限公司
- 滁州揚子凈化設備有限公司
- 滁州揚子華寶生活電器有限公司
- 滁州揚子沃特凈化設備有限公司
- 中國水電路橋武邵高速公路六標項目質量檢驗試驗計劃
- 宜興沈北路二號橋大直徑鉆孔灌注樁的施工與質量控制
- 園林綠化技術資料鋼結構油漆分項工程質量檢驗評定表
- 以建筑工程資料管理的規范化促進工程質量的管理監督
- 影響水利工程質量監督職能發揮的主要因素及對策分析
- 執行設備工程監理規范提升地鐵設備監理服務質量
- 應用工程建設施工企業質量管理規范進行體系轉換
- 岳城水庫大副壩防滲墻塑性混凝土施工工藝及質量控制
- 引用CAD電子圖在廣聯達工程計算軟件中的應用技巧
- 影響工程項目管理中的質量因素與提高質量管理的對策
- 應用于建筑10kV進線的電能質量在線監測裝置
- 異形柱框架及短肢墻抗震節點構造的施工質量保證措施
- 智能建筑電氣安裝中的質量控制
- 圓形截面鋼筋混凝土受彎構件正截面承載力的簡化計算
- 中華人民共和國水產行業標準玻璃鋼漁船建造質量要求
- 影響我國公路橋梁板式橡膠支座質量的因素及應對措施