增烴水煤氣水煤氣和增烴水煤氣對比
生產水煤氣一般用焦炭作燃料,因為焦炭的碳含量和清潔度都很高。也有用無煙煤、煙煤以及煤和焦炭的混合物的,而且較為成功,但是整個操作效率要有些降低。
水煤氣燃燒時帶有明亮的藍火焰,所以稱為“藍水煤氣”。水煤氣用于許多化學工程,可以為合成工藝的基本燃氣,但是不宜用作家庭燃料,除非用熱解的燃料油增烴,制得所謂的增烴水煤氣。
焦炭制得的水煤氣然燒時不帶光焰,而增烴水煤氣燃燒時具有很強的光焰,不過,這兩種水煤氣的燃燒速度超過其它任何廣泛使用的燃氣;增烴水煤氣的燃燒速度實際上與焦爐煤氣相當。水煤氣的比重比天然氣的稍小一點,但是比焦爐煤氣要大;增烴水氣比重比天然氣大,但是比發生爐煤氣要小。藍水煤氣和增烴水煤氣兩者的理論火焰溫度很,分別約為2020°C和2050°C,超過通常使用的所有其它工業燃氣。這兩種水煤氣都具有相當寬的爆炸范圍。
增烴水煤氣造價信息
亦稱蘭焰水煤氣。是一種比較清潔的低級燃料氣,主要用于工業中對材料加熱以及用作爐子的燃料。水煤氣是使過熱蒸汽通過紅熱的焦炭床而產生出來的。蒸汽部分地使碳氧化形成一氧化碳,而它本身則還原為氫氣。水煤氣的主要成分是一氧化碳(40至45%)和氫(45至51%),其比例視反應條件而定。水煤氣還含一些二氧化碳、怎和微量的甲烷。一氧化碳和氫都是可燃的,但此混合氣的熱值不很高,約為350英熱單位/英尺(13.0兆焦耳/米)。
蒸汽與焦炭之間的反應要吸熱,使焦炭床的溫度急劇下降。因此,焦炭床要用吹氣再加熱。這樣就使過程成為斷續的一一焦炭再加熱吹氣的一分鐘,再送蒸汽三分鐘。
吹氣階段產生的水煤氣常常經煙道排出而浪廢掉。但是,如果焦炭床足夠厚,吸氣階段就可產生出叫作發生爐煤氣的一氧化碳和氮的混合氣。由于一氧化碳也是可燃的,可以與水煤氣相混合,這樣主要由一氧化碳、氫和氮組成的混合氣叫作半水煤氣。
使蒸汽通過熱焦炭而制成的水煤氣,為提高水煤氣濃度還使粗柴油同時通過焦炭。最終產品增烴水煤氣的熱值約500英熱單位/立方英尺(18.7兆焦耳/立方米)。增烴水煤氣由美國早在上世紀發明的方法生產,而且是用石油產品生產煤氣的第一種應用場合。
增烴水煤氣水煤氣和增烴水煤氣對比常見問題
-
水煤氣其實就是水蒸氣和灼熱的焦炭反應。水蒸氣和灼熱的焦炭在高溫的條件下反應生成氫氣和:H2O+C=高溫=H2+CO(反應物的水是以水蒸氣氣態的形式存在,所以生成物的氣體不需要標氣體符號)。然后生成的氫...
-
水煤氣行業的“工業革命” ——洛陽豫燃”兩步法水煤氣制造工藝” 撰稿 張金輝 肖繼平 指導 陶予敏 邁入二十一世紀,人類不得不承認,伴隨著新科技,新文明的到來.能源危機的紅燈頻頻亮起。石油、煤炭、天然...
-
套鋼管敷設子目。
增烴水煤氣水煤氣和增烴水煤氣對比文獻

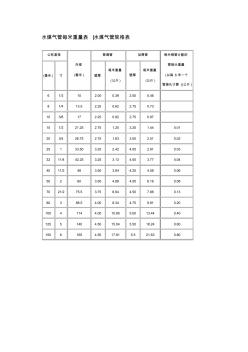 水煤氣鋼管表
水煤氣鋼管表
格式:pdf
大小:26KB
頁數: 1頁
評分: 4.5
水煤氣管每米重量表 |水煤氣管規格表 公稱直徑 外徑 (毫米 ) 普通管 加厚管 每米鋼管分配的 管接頭重量 (以每 6米一個 管接頭計算 )(公斤 ) (毫米 ) 寸 壁厚 每米重量 (公斤 ) 壁厚 每米重量 (公斤 ) 6 1/3 10 2.00 0.39 2.50 0.46 8 1/4 13.5 2.25 0.62 2.75 0.73 10 3/8 17 2.25 0.82 2.75 0.97 15 1/2 21.25 2.75 1.25 3.25 1.44 0.01 20 3/4 26.75 2.75 1.63 3.50 2.01 0.02 25 1 33.50 3.25 2.42 4.00 2.91 0.03 32 11/4 42.25 3.25 3.13 4.00 3.77 0.04 40 11/2 48 3.50 3.84 4.25 4.58 0.06

 焦爐煤氣配半水煤氣生產合成氨擴能改造
焦爐煤氣配半水煤氣生產合成氨擴能改造
格式:pdf
大小:26KB
頁數: 4頁
評分: 4.4
分析了山西豐喜華瑞煤化工公司焦爐煤氣配半水煤氣生產合成氨18-30項目生產工藝流程,結合周邊焦化廠富余焦爐煤氣的實際供應情況,對原工藝流程進行優化,改造方案為:增加變壓吸附提氫工序、強化甲烷轉化工藝條件、增加部分設備等。通過改造,可使合成氨生產能力由18萬t/a提高到24萬t/a、尿素生產能力由30萬t/a提高到40萬t/a,取得較好的經濟效益和社會效益。
炔烴是一類有機化合物,屬于不飽和烴。其官能團為碳碳三鍵(-C≡C-)。直鏈單炔烴的通式CnH2n-2,其中n為≥2的正整數。簡單的炔烴化合物有乙炔(C2H2)、丙炔(C3H4)等。炔烴原來也被叫做電石氣,電石氣通常也被用來特指炔烴中最簡單的乙炔。
“炔”字是新造字,左邊的火取自“碳”字,表示可以燃燒;右邊的夬取自“缺”字,表示氫原子數和化合價比烯烴更加缺少,意味著炔是烷(完整)和烯(稀少)的不飽和衍生物。
簡單的炔烴的熔點、沸點,密度均比具有相同碳原子數的烷烴或烯烴高一些。不易溶于水,易溶于乙醚、苯、四氯化碳等有機溶劑中。炔烴可以和鹵素、氫、鹵化氫、水發生加成反應,也可發生聚合反應。 因為炔在燃燒時放出大量的熱,炔又常被用來做焊接時的原料。
近幾年來,正在開發高溫氣冷堆的技術,用氦為熱載體將核反應熱轉送至氣化爐作為熱源,以生產水煤氣。
炔烴的一般制備是通過鄰二鹵化烷烴的脫鹵化氫作用,也可以通過金屬炔化合物與一級鹵化烷反應制得。在Fritsch-Buttenberg-Wiechell重排中,炔烴又溴化乙烯基起始制得。
炔烴也可以由醛通過Corey-Fuchs反應制得,亦可以通過Seyferth-Gilbert同素化制得。
乙炔制作用煤或石油作原料,是生產乙炔的兩種主要途徑。隨著天然氣化學工業的發展,天然氣即將成為乙炔的主要來源。
炔烴電弧法
甲烷在1500℃電弧中經極短時間(0.1~0.01s)加熱,裂解成乙炔,即:
2CH4→C2H2 3H2,ΔH=397.4KJ/mol
由于乙炔在高溫很快分解成碳,故反應氣須用水很快地冷卻,乙炔產率約15%,改用氣流冷卻反應氣,可提高乙炔產率達25%~30%。裂解氣中還含有乙烯、氫和碳塵。這個方法的總特點是原料非常便宜,在天然氣豐富的地區采用這個方法是比較經濟的。石腦油也可用此方法生產乙炔。
炔烴電石法
用焦炭和氧化鈣經電弧加熱至2200℃,制成碳化鈣(CaC2),它再與水反應,生成乙炔和氫氧化鈣:
CaO 3C<—2200℃—>CaC2 CO,ΔH=460kJ/mol
CaC2 2H2O——>C2H2 Ca(OH)2
此法成本較高,除少數國家外,均不用此法。
炔烴等離子法
用石油和極熱的氫氣一起熱裂制備乙炔,即把氫氣在3500~4000℃的電弧中加熱,然后部分等離子化的等離子體氫(正負離子相等)于電弧加熱器出口的分離反應室中與氣體的或氣化了的石油氣反應,生成的產物有:乙炔、乙烯(二者的總產率在70%以上)以及甲烷和氫氣。
乙炔過去是非常重要的有機合成原料,由于乙炔的生產成本相當高,以乙炔為原料生產化學品的路線逐漸被以其他化合物(特別是乙烯、丙烯)為原料的路線所取代。
純的乙炔是帶有乙醚氣味的氣體,具有麻醉作用,燃燒時火焰明亮,可用以照明。工業乙炔不好聞氣味是由于含有硫化氫、磷化氫、以及有機磷、硫化合物等雜質引起的。與乙烯、乙烷不同,乙炔在水中具有一定的溶解度,但易溶于丙酮。液化乙炔經碰撞、加熱可發生劇烈爆炸,乙炔與空氣混合、當它的含量達到3~70%時,會劇烈爆炸。商業上為安全地處理乙炔,把它裝入鋼瓶中,瓶內裝有多孔材料,如硅藻土、浮石或木炭,再裝入丙酮。丙酮在常壓下,約可溶解相當于它體積25倍的乙炔,而在1.2MPa下可溶解相當其體積300倍的乙炔。乙炔和氧氣混合燃燒,可產生2800℃的高溫,用以焊接或切割鋼鐵及其他金屬。
- 相關百科
- 相關知識
- 相關專欄
- 增量計算法
- 增長型永續年金
- 墨溝石灰巖
- 墨輪打碼機
- 墨輥
- 壁畫取暖器
- 壁虎(英國)有限公司
- 壁面熱流
- 壕豬刺
- 壤塘縣發展和改革委員會
- 壤塘縣建筑安裝裝飾工程公司
- 士興國際集團
- 聲光材料
- 聲卡芯片廠家
- 聲威W001
- 聲子晶體型壓電換能器的設計原理和實驗研究
- 在全縣非煤礦山和危化企業安全生產工作會議上的講話
- 支持并行工程和智能CAPP的制造資源建模技術
- 云計算對企業信息化系統建設和運營的影響分析和改進
- 政府和社會資本合作(PPP)項目物有所值評價
- 新的基于NGA/PCA和SVM的特征提取方法
- 中華人民共和國國家標準建設工程工程量清單計價規范
- 永春縣農田水利設施產權制度改革和運行管護機制試點
- 異形人工挖孔樁和預應力土層錨桿組合在基坑中的應用
- 政府投資建設項目在財務管理上面臨的風險和應對措施
- 指路標志(里程碑和百米碑)施工記錄表
- 在城鄉統籌就業和勞動社會保障試點工作會議上的講話
- 基于CMOS工藝的二維風速傳感器的設計和測試
- 制藥用水系統使用點取樣閥門的應用設計和選型論文
- 中華人民共和國大氣污染防治法實施細則中英對照資料
- 依托實驗教學示范中心培養工程實踐能力的探索和實踐
- 應用CAO型消煙節能燃煤裝置改造鍛造和退火加熱爐